

重点
酸的通性、金属活动性顺序以及溶液的pH。
难点
使学生在增长知识的同时,逐步掌握一些分析和解决问题的方法。
教具学具准备
锌、镁、铁,铜,银,稀盐酸,氢氧化钠溶液,酚酞试液,pH试纸。
教学过程
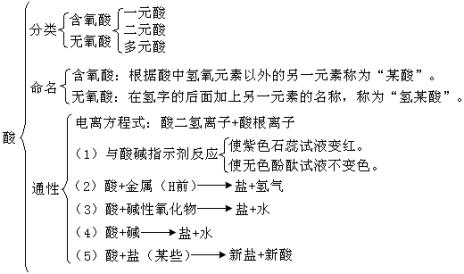
1.酸的分类和命名
教师课前准备一些习题,上课时让学生完成下列习题:
写出下列物质的电离方程式:
![]()
![]()
![]()
![]()
![]()
![]()
通过学生写出上述物质的电离方程式,引导学生可按酸的组成情况抓住共性来考虑怎样分类。酸可以按是否含有氧元素分为含氧酸、无氧酸;或者按电离时所能生成的氢离子的个数,可以分为一元酸,二元酸,三元酸……两种方法进行分类。
从熟悉的含氧酸和无氧酸的名称抽象出酸的命名方法。
2.酸的通性
通过复习盐酸、稀硫酸的化学性质,概括出它们的共性—即酸的通性:
(1)与酸碱指示剂反应
使紫色石蕊试液变红色,使无色酚酞试液不变色。
(2)酸+活泼金属→盐+氢气
(3)酸+碱性氧化物→盐+水
(4)酸+碱→盐+水
(5)酸+某些盐→新盐+新酸
3.金属活动性顺序
学生分组[实验8—19]铜、银、锌、镁、铁与稀硫酸反应,由实验现象讨论其实质,最后在教师的引导下得出不同种金属其化学活泼性是不同的,引出金属活动性顺序表。
学生通过看书阅读得到以下两点:
(1)金属活动性是指金属原子在水溶液中丢失电子的能力,金属的位置越靠前,金属在水溶液中就越容易丢失电子变成离子,它的活动性就越强。
(2)排在氢前面的金属能置换出酸里的氢,排在氢后面的金属则不能。
最后强调:酸+金属→盐+氢气中①金属必在金属活动顺序表中氢前的;②酸不包括浓硫酸和硝酸;③金属如果是铁,则生成亚铁盐。
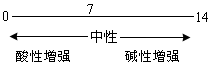
4.pH—酸碱度的表示法
教师提问:如何试验溶液是显酸性还是显碱性?
通过学生的回答,举一些例子说明在生产、科研、生活中,有时只知道溶液是显酸性,还是显碱性是非常不够的。例如,电镀厂的酸洗液和人体的胃液都是酸性的,但是两者所起的作用却大不相同。引出溶液的酸碱度,即溶液酸碱性强弱的程度,进一步引出pH及pH的范围和如何测定溶液的pH。
请同学们阅读有关教材,使他们体会测定溶液酸碱度在生产、生活和科研中的实际意义。
总结
1.酸的分类、命名、通性
2.pH—酸碱度的表示法
教案点评:
本节教学除金属活动性顺序、中和反应和pH是新知识外,其他都是上一节知识的概括和总结,主要采用的是复习、归纳跟实验相结合的方法。在金属的活动性教学中,采用学生分组实验的方法,有效的突破了重难点并调动了学生学习的积极性;对于pH的教学,采用阅读和讲解的方法。


