|
1、电解质和非电解质
| 电解质和非电解质 |
 |
电解质:凡在水溶液或熔化状态下能导电的化合物。如:NaCl、MgSO4等; |
| 非电解质:在水溶液或熔化状态下都不导电的化合物。如:NH3、SO2等。 | |
|
2、强电解质弱电解质
|
强电解质:在水溶液中全部电离为离子的电解质 |
 |
强酸:HCl、HNO3、H2SO4; |
| 强碱:Ba(OH)2、NaOH、KOH; |
| 大多数盐:CaCO3、BaSO4、NaCl、K2SO4; |
| 弱电解质:在水溶液中部分电离为离子的电解质 |
 |
弱酸:HF、HClO、CH3COOH、H2SO3、H2S; |
| 弱碱:Cu(OH)2等绝大多数的碱;少数盐。 |
|
|
3、离子反应和离子方程式
|
|
4、离子方程式正误判断
| (1)是否符合客观事实。如: |
|
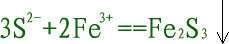
错误,三价铁离子与硫离子要发生氧化还原反应。 |
| (2)符号使用是否正确。如: |
|

错误,三价铁离子水解要用可逆符号。Fe(OH)3为胶体,不能打沉淀符号。 |
| (3)是否遵循三大守恒,质量守恒、电荷守恒和电子得失守恒。如: |
|
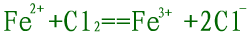
错误,电荷不守恒。 |
| (4)是否考虑量的影响和隐离子反应。如: |
|
将少量澄清石灰水加入NaHCO3溶液中,
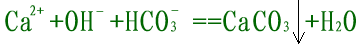
错误,没有考虑NaHCO3过量问题。
再如:H2SO4与Ba(OH)2反应,
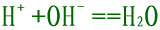
错误,忽略了隐离子反应:
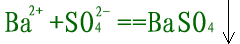
|
|
|
5、离子能否大量共存判断
| (1)结合生成难溶物质的离子不能大量共存,如: |
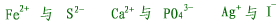 |
| (2)结合生成气体物质的离子不能大量共存,如: |
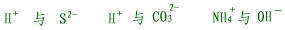 |
| (3)结合生成难电离物质的离子不能大量共存,如: |
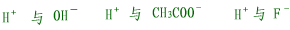 |
| (4)发生氧化还原反应的离子不能大量共存,如: |
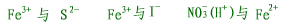 |
| (5)发生双水解反应的离子不能大量共存,如: |
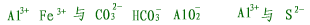 |
| (6)弱酸酸式酸根离子不能与氢离子、氢氧根离子共存,如: |
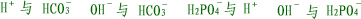 |
| (7)在题中提示酸性溶液(PH < 7)或碱性溶液(PH > 7)应在各待选答案中均加入氢离子或氢氧根离子综合考虑。 |
|
| (8)在题目中告知是无色溶液,应在各待选答案中排除具有颜色的离了,如: |
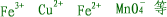 |
................................... |




